نفسر ماهية الذرة وكيف يتكون كل جزء من أجزائها. أيضا ، تاريخه ، ودراسات عنه وما هو الجزيء.

ما هي الذرة؟
أصغر وحدة تتكون من موضوع.
تأتي كلمة ذرة من اليونانية القديمة (ذرة، "بدون تقسيم") وقد صاغها الفلاسفة الأوائل للتنظير حول تكوين الأشياء ، أي الجسيمات الأولية كون. منذ ذلك الحين ، مع ظهور النماذج الذريةلقد اختلفت طريقة تخيلها بشكل كبير ، حيث نجح النموذج الذري في النموذج السابق عبر القرون ، حتى وصلنا إلى النموذج الذي نستخدمه اليوم.
الذرات لها خصائص عنصر كيميائي التي تتكون منها ، وبالتالي ، يتم تنظيم العناصر وتصنيفها وفقًا لها الأعداد الذريةوالتكوين الإلكتروني والخصائص الكيميائية في الجدول الدوري من العناصر.
يمكن أن يتكون العنصر الكيميائي نفسه من ذرات مختلفة من نفس الفئة ، أي بنفس العدد الذري (عدد البروتونات أن كل ذرة في العنصر) ، على الرغم من اختلاف كتلها الذرية.
على سبيل المثال ، هناك ذرات مختلفة لنفس العنصر تختلف في عددها النيوترونات، وتسمى النظائر ، حالة تمثيلية هي نظائر عنصر الكربون (12 درجة مئوية ، 13 درجة مئوية ، 14 درجة مئوية). لذلك ، تنتمي كل ذرة إلى نفس العنصر الكيميائي أم لا ، اعتمادًا على عدد البروتونات الخاصة بها ، لذلك تنتمي الذرات التي تحتوي على نفس عدد البروتونات إلى نفس العنصر الكيميائي.
كيف تتكون الذرة؟
تتكون الذرات من نواة وإلكترون واحد أو أكثر (لها شحنة سالبة) حولها. تتكون النواة من جسيمات تسمى البروتونات والنيوترونات. البروتونات موجبة الشحنة والنيوترونات متعادلة. تسمى مجموعة البروتونات والنيوترونات بالنيوكليونات.
تنجذب البروتونات والإلكترونات لبعضها البعض من خلال القوة الكهرومغناطيسية (تفاعل الجسيمات المشحونة مع المجالات الكهربائية والمغناطيسية) ، بينما تنجذب البروتونات والنيوترونات إلى بعضها البعض بواسطة القوة النووية (القوة التي تعاني منها فقط الجسيمات التي تتكون منها النواة الذرية).
كيف تتحد الذرات؟
يمكن أن تتحد الذرات مع بعضها البعض لتشكل روابط كيميائية، ماذا يحدث عندما يتشاركون إلكتروناتهم بطريقة أو بأخرى. يمكن أن تكون الروابط الكيميائية تساهمية, أيوني ص معدني، الذي ينشأ المركبات الجزيئية التساهمية أو الشبكات الأيونية أو المركبات المعدنية (على الرغم من أنه من المهم توضيح أنه لا توجد رابطة كيميائية تساهمية أو أيونية تمامًا). بهذه الطريقة ، يمكن للذرات أن تتحد لتتشكل الجزيئات بسيط مثل ماء، وكذلك لتشكيل الجزيئات الكبيرة معقدة مثل بروتين, الحمض النووي ص RNA.
على الرغم من أن الذرات تتميز عن بعضها البعض بفضل تكوين جزيئاتها ، فمن الصحيح أيضًا أن جميع ذرات نفس العنصر متطابقة تمامًا: ذرات الهيدروجين في شمس إنها نفس تلك التي تتكون منها أجسامنا ، وذرات الكربون في جسم الكلب متطابقة مع تلك التي تشكل الماس. يكمن الاختلاف في الطريقة التي تتحد بها الذرات لتشكل المركبات الكيميائية المختلفة التي تشكل الأعضاء وأنظمة الأعضاء في كائنات حية، والمواد المتولدة في صناعة، وكل المادة التي يتكون منها الكون.
أجزاء من ذرة
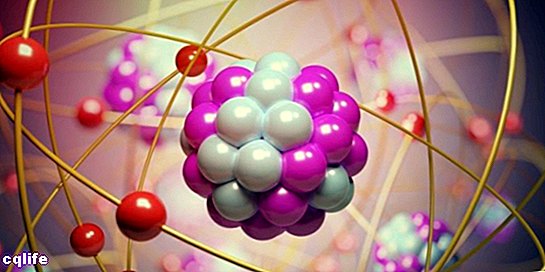
تتكون الذرات من جزأين أساسيين:
- النواة. يتركز حوالي 99.94٪ من كتلة الذرة في النواة ، حيث ترتبط البروتونات والنيوترونات (التي تسمى معًا "نيوترونات") بقوى نووية قوية ، مما يمنع البروتونات التي تتنافر مع بعضها البعض ، ولها نفس القوة الكهربائية الشحنة.
- المدارات الذرية. يصف المدار منطقة من الفضاء تحيط بالنواة الذرية حيث يكون احتمالا العثور على إلكترون مرتفع للغاية. هذه المناطق لها أشكال مختلفة يتم الحصول عليها نتيجة لحل معادلة شرودنغر الثابتة. كان إروين شرودنجر عالمًا نمساويًا طور هذه المعادلة في عام 1925 لحساب تطور الجسيمات دون الذرية ، مثل الإلكترونات. وهكذا ، تشكل الإلكترونات نوعًا من "السحابة" حول النواة ، والتي يتم تمثيلها بشكل المدارات الذرية. من ناحية أخرى ، يتوافق كل مدار ذري مع قيمة طاقة معينة للإلكترونات ، لذلك يتم تنظيمها وفقًا لقيم طاقتها. يوضح الشكل التالي أشكال المدارات الذرية الأولى:

تاريخ الذرة

كان الفيلسوف اليوناني ديموقريطس (ق.V-VI قبل الميلاد) من تكهنات خيالية بحتة (كما كان يُفهم العلم في ذلك الوقت).
تم تناول دراساته من قبل الفلاسفة اللاحقين مثل Leucippus و Epicurus ، ولكن تم إهمالها خلال من القرون الوسطى، طغت عليه التفسير الخلقي للعالم ، الذي ينسب كل شيء إلى الله.
كان علينا الانتظار حتى عام 1773 عندما افترض الكيميائي الفرنسي أنطوان دي لافوازييه نظريته حول عدم خلق أو تدمير المادة (إنها تتحول فقط) أو قانون حفظ الكتلة، مما سمح لجون دالتون بصياغة أول نظرية ذرية حديثة في عام 1804.
المتعاقبون من العلماء جسدي - بدني و ال كيمياء لقد استلهموا من عمله لاقتراح أنظمة أفضل وأكثر تعقيدًا لفهم الجسيمات الأساسية للمادة. بعد ذلك ، تم اقتراح نماذج ذرية جديدة حتى أكثر النماذج المستخدمة اليوم.
الهيكل المعاصر المعاصر هو الذي مشتق من التجارب رذرفورد في عام 1911 ، جنبًا إلى جنب مع تركيبات نيلز بور وشرودنجر وهايزنبرج.
مركب
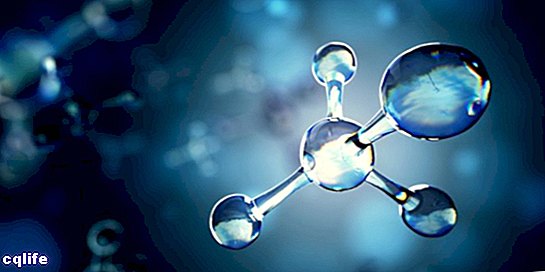
يُعرف الجزيء باسم اتحاد ذرتين أو أكثر من خلال روابط كيميائية لتشكيل بنية أكثر تعقيدًا ومحايدة كهربيًا. يمكن أن تكون الروابط الكيميائية تساهمية أو أيونية.
يمكن أن تتكون الجزيئات من ذرات من نفس العنصر الكيميائي ، على سبيل المثال ، جزيء الأكسجين (O2) ، أو من ذرات من عناصر كيميائية مختلفة ، على سبيل المثال ، جزيء الجلوكوز. تعتبر الغازات أحادية الذرة ، على سبيل المثال الهيليوم (He) ، جزيئات أيضًا.

